器官移植是终末期器官衰竭患者最有效的治疗方法,但是移植免疫排斥始终是导致移植失败的主要障碍。树突状细胞(Dendritic cells,DC)和巨噬细胞作为最主要的抗原提呈细胞(antigen presenting cells,APCs),在启动针对移植物的免疫排斥反应中发挥重要作用。共刺激信号是抗原提呈细胞活化T淋巴细胞的关键第二信号,其缺失会导致T淋巴细胞失能。研究表明,CD40/CD40L共刺激信号通路是抑制移植免疫排斥反应的重要靶点,阻断CD40/CD40L信号通路是诱导移植免疫耐受的有效策略。例如,CD40L阻断抗体在动物实验中成功诱导了移植免疫耐受,但由于人血小板表达CD40L分子,在临床试验中CD40L阻断抗体导致了凝血与血栓形成等严重的副作用,使其无法应用于临床治疗。因此,开发安全、高效阻断CD40/CD40L途径的新策略就成为亟待解决的问题。
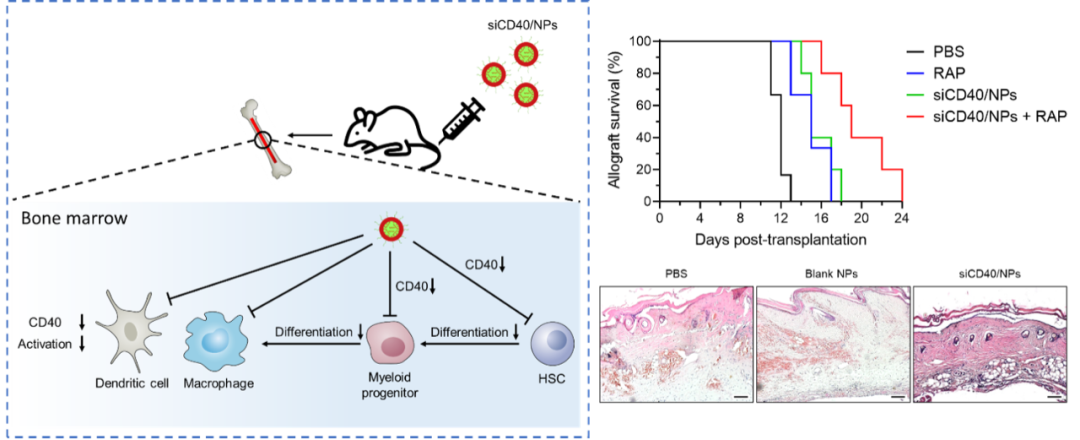
近日,实验室杨永广教授和孙天盟教授课题组在国际知名期刊Science Advances JCR分区1区,中科院分区1区,IF=14.957)杂志上发表了题为“Nanoparticle delivery of CD40 siRNA suppresses alloimmune responses by inhibiting activation and differentiation of DCs and macrophages”的文章,报道了利用负载CD40 siRNA的纳米药物载体抑制DC和巨噬细胞分化与成熟,成功诱导移植免疫耐受的研究工作。本研究首次揭示了CD40分子在造血干细胞、髓系前体细胞与祖细胞向DC和巨噬细胞分化与成熟过程中的重要作用。在利用抗体阻断CD40信号的研究中并未见到相关报道,主要原因是抗体等大分子药物难以有效进入骨髓中发挥作用,而纳米药物载体在靶向骨髓细胞递送药物中显示出了优势,能够克服骨髓复杂微环境导致的药物递送障碍,实现靶向骨髓中干细胞、髓系前体细胞与祖细胞的高效药物递送,为研究CD40分子在DC和巨噬细胞分化过程中的作用提供了可行性。
本文的研究人员通过双乳化法制备了一种能够高效包载CD40 siRNA的阳离子脂质辅助纳米药物(siCD40/NPs)。在体内实验中,静脉注射的siCD40/NPs能够富集于DC和巨噬细胞中,降低CD40的表达水平,有效降低LPS刺激后DC和巨噬细胞的活化水平。进一步的研究发现,除了成熟的DC和巨噬细胞外,siCD40/NPs还能够将CD40 siRNA递送至骨髓中的造血干细胞、髓系前体细胞和祖细胞中,从而显著抑制DC和巨噬细胞的分化与成熟,降低其数量和比例。同种异基因皮肤移植会在移植物受体体内诱导强烈的免疫排斥反应。在小鼠同种异基因皮肤移植模型中,siCD40/NPs显著延长小鼠皮肤移植物的存活时间,并且siCD40/NPs联合雷帕霉素进一步延长了小鼠同种异基因皮肤移植物的存活期。
论文作者为免疫学博士王嘉良;孙天盟教授和杨永广教授为论文共同通讯作者。